Aplikasi Prinsip Kesetimbangan Kimia dalam Industri
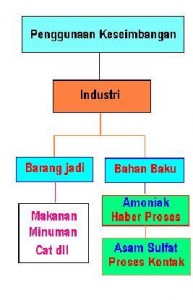 Banyak proses industri zat kimia yang didasarkan pada reaksi kesetimbangan. Agar efesien, kondisi reaksi haruslah diusahakan sedemikian sehingga menggeser kesetimbangan ke arah produk dan meminimalkan reaksi balik. Misalnya:
Banyak proses industri zat kimia yang didasarkan pada reaksi kesetimbangan. Agar efesien, kondisi reaksi haruslah diusahakan sedemikian sehingga menggeser kesetimbangan ke arah produk dan meminimalkan reaksi balik. Misalnya:
1) Pembuatan Amonia menurut proses Haber-Bosch
Nitrogen terdapat melimpah di udara, yaitu sekitar 78% volume. Walaupun demikian, senyawa nitrogen tidak terdapat banyak di alam. Satu-satunya sumber alam yang penting ialah NaNO3 yang disebutSendawa Chili. Sementara itu, kebutuhan senyawa nitrogen semakin banyak, misalnya untuk industri pupuk, dan bahan peledak. Oleh karena itu, proses sintesis senyawa nitrogen, fiksasi nitrogen buatan, merupakan proses industri yang sangat penting. Metode yang utama adalah mereaksikan nitrogen dengan hidrogen membentuk amonia. Selanjutnya amonia dapat diubah menjadi senyawa nitrogen lain seperti asam nitrat dan garam nitrat.
Dasar teori pembuatan amonia dari nitrogen dan hidrogen ditemukan oleh Fritz Haber (1908), seorang ahli kimia dari Jerman. Sedangkan proses industri pembuatan amonia untuk produksi secara besar-besaran ditemukan oleh Carl Bosch, seorang insinyur kimia juga dari Jerman.
Persamaan ini mengindikasikan bahwa 2 mol amoniak terbentuk dari 1 mol gas N2dan 3 mol gas H2, dari persamaan ini juga mengindikasikan bahwa reaksi adalah eksoterm, sehingga amoniak akan terbentuk dengan baik pada suhu rendah.
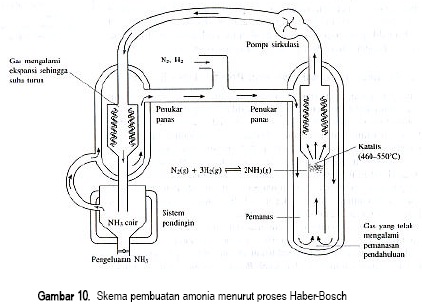
Berdasarkan prinsip kesetimbangan kondisi yang menguntungkan untuk ketuntasan reaksi ke kanan (pembentukan NH3) adalah suhu rendah dan tekanan tinggi. Akan tetapi, reaksi tersebut berlangsung sangat lambat pada suhu rendah. Dipihak lain, karena reaksi ke kanan eksoterm, penambahan suhu akan mengurangi rendemen. Usaha untuk meningkatkan jumlah dengan kecepatan yang cukup dilakukan dengan mengatur tekanan dan suhu dan menambahkan katalisator.
Untuk proses yang optimal didapat dengan mengatur suhu sebesar 500ºC dan dengan tekanan 350 atm, dengan kondisi ini didapatkan produk amoniak sebesar 30%.
Dewasa ini, seiring dengan kemajuan teknologi, digunakan tekanan yang jauh lebih besar, bahkan mencapai 700 atm. Untuk mengurangi reaksi balik, maka amonia yang terbentuk segera dipisahkan.
Mula-mula campuran gas nitrogen dan hidrogen dikompresi (dimampatkan) hingga mencapai tekanan yang diinginkan. Kemudian campuran gas dipanaskan dalam suatu ruangan yang bersama katalisator sehingga terbentuk amonia.
Diagram alur dari proses Haber-bosch untuk sintesis ammonia yaitu sbb:
2) Pembuatan Asam Sulfat Menurut Proses Kontak
Industri lainnya yang berdasarkan reaksi kesetimbangan yaitu pembuatan asam sulfat yang dikenal dengan proses kontak. Reaksi yang terjadi dapat diringkas sebagai berikut :
Tahap penting dalam proses ini adalah reaksi (b). Reaksi ini merupakan reaksi kesetimbangan dan eksoterm. Sama seperti pada sintesis amonia, reaksi ini hanya berlangsung baik pada suhu tinggi. Akan tetapi pada suhu tinggi justru kesetimbangan bergeser ke kiri.
Belerang trioksida merupakan produk yang vital sebagai bahan pembentuk asam sulfat. Dari persamaan reaksi di atas diketahui reaksi bersifat eksoterm. Reaksi lebih baik berlangsung pada suhu rendah, namun reaksi ini berjalan sangat lambat. Untuk mempercepat reaksi pembentukan belerang trioksida dipergunakan katalisator Vanadium oksida (V2O5) dan berlangsung pada suhu 400ºC.
Dalam industri kimia, jika campuran reaksi kesetimbangan mencapai kesetimbangan maka produk reaksi tidak bertambah lagi. Akan tetapi produk reaksinya diambil atau disisihkan, maka akan menghasilkan lagi produk reaksi.
Amonia yang terbentuk dipisahkan dari campuran kesetimbangan dengan cara pencarian dari gas nitrogen di daur ulang ke wadah reaksi untuk menghasilkan produk reaksi.
Dalam industri makanan, reaksi kesetimbangan juga berlangsung, seperti pada pembuatan tape, dan minuman beralkohol, perhatikan bagan berikut.
Pada prinsipnya yang dipergunakan adalah ragi atau jamur, selanjutnya ragi menghasilkan enzim pembongkar karbohidrat membentuk molekul kecil glukosa dan fruktosa. Namun dalam prosesnya juga dihasilkan senyawa-senyawa lain seperti alkohol, aldehid yang menyebabkan aroma minuman atau tape menjadi harum. Selain itu enzim juga dapat mengoksidasi secara sempurna dan dihasilkan asam-asam karboksilat. Sehingga kita juga rasakan tape yang terasa asam. Jika kita coba mencermati, maka kita dapat menemukan bahan makanan atau bumbu masak yang lain yang merupakan produk hasil dari reaksi kesetimbangan dan juga zat-zat yang berfungsi sebagai katalisator.
Banyak proses alamiah dalam kehidupan sehari-hari berkaitan dengan perubahan konsentrasi pada sistem kesetimbangan. pH darah dan jaringan badan kira-kira 7,4 . Harga ini diatur dalam darah berada dalam kesetimbangan dengan ion hidrogen karbonat dan ion hidrogen.
Jika konsentrasi ion hidrogen bertambah, ion-ion ini bereaksi dengan ion hidrogen karbonat. Jika konsentrasi ion hidrogen terlampau rendah, asam karbonat bereaksi menghasilkan hidrogen. Oksigen diangkut dari paru-paru ke sel badan oleh haemoglobin dalam sel darah merah. Dalam paru-paru, konsentrasi oksigen cukup tinggi dan haemoglobin bereaksi dengan oksigen membentuk oksihemoglobin. Reaksi ini dapat ditulis,
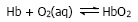
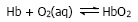
Dalam jaringan tubuh, konsentrasi oksigen rendah, sehingga reaksi sebaliknya yang terjadi, yaitu menghasilkan oksigen untuk digunakan dalam sel tubuh.
Ketika oksigen diangkut dari paru-paru ke jaringan tubuh, karbon dioksida yang dihasilkan oleh respirasi sel angkut dari jaringan tubuh ke paru-paru.
Dalam jaringan tubuh karbon dioksida yang konsentrasinya relatif tinggi melarut dalam darah bereaksi dengan air membentuk asam karbonat.
Ketika oksigen diangkut dari paru-paru ke jaringan tubuh, karbon dioksida yang dihasilkan oleh respirasi sel angkut dari jaringan tubuh ke paru-paru.
Dalam jaringan tubuh karbon dioksida yang konsentrasinya relatif tinggi melarut dalam darah bereaksi dengan air membentuk asam karbonat.
Dalam paru-paru di mana konsentrasi karbon dioksida relatif rendah, reaksi sebaliknya yang terjadi dan karbon dikeluarkan dari darah ke udara.
Jika air tanah mengalir melalui daerah berkapur, maka batu kapur melarut. Jika air berjumpa dengan udara yang mengandung sedikit karbondioksida maka karbon dioksida akan dilepaskan dari larutan ke udara, sehingga kalsium karbonat mengendap
http://www.chem-is-try.org/materi_kimia/kimia-kesehatan/kesetimbangan-kimia/aplikasi-kesetimbangan-kimia-dalam-industri/26
http://www.chem-is-try.org/materi_kimia/kimia-kesehatan/kesetimbangan-kimia/aplikasi-kesetimbangan-kimia-dalam-industri/26
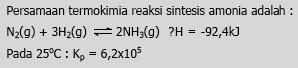



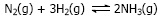
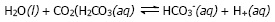
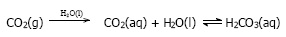


Komentar
Posting Komentar